Salze Eigenschaften und Bildung online lernen

Pin auf Learning Level Up Lernvideos
Eine Metallbindung (auch metallische Bindung oder ungerichtete Bindung) ist eine Bindung von Metallen, die ihre Valenzelektronen zur Verfügung stellen und somit ein Elektronengas bilden. Das Elektronengas kann von allen beteiligten Metallatomen genutzt werden, um die Edelgaskonfiguration zu erreichen.
Wichtige Salze und ihre Bedeutung online lernen
Eine Ionenbindung ist eine elektrostatische Wechselwirkung zwischen Ionen. Das bedeutet, dass sich Ionen, also Kationen und Anionen, gegenseitig anziehen. Die Ionenbindung ist die stärkste Bindung, die zwischen Teilchen herrschen kann. Erfüllung der Oktettregel Alle Atome wollen die Oktettregel erfüllen.

Gitterstrukturen sehr einfach erklärt 1a Technikermathe
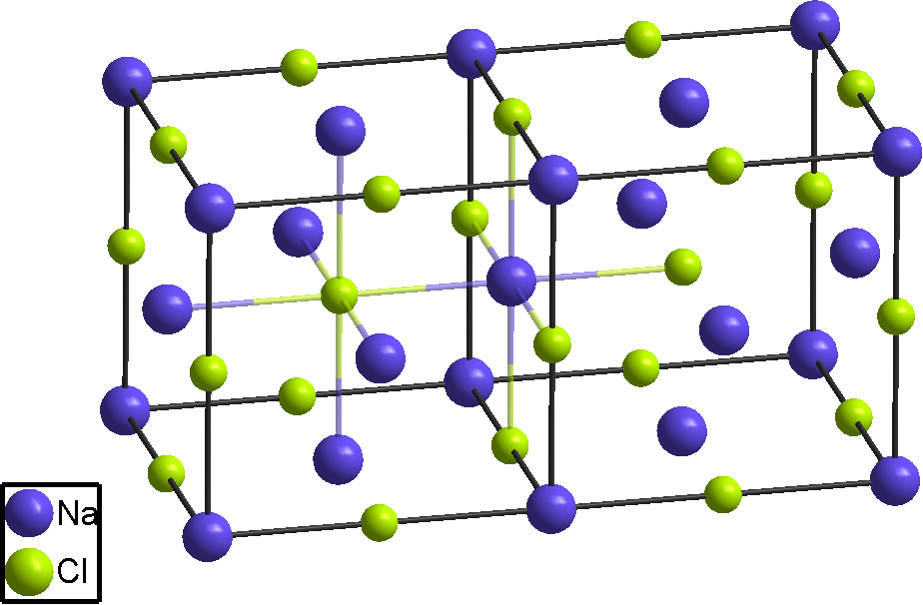
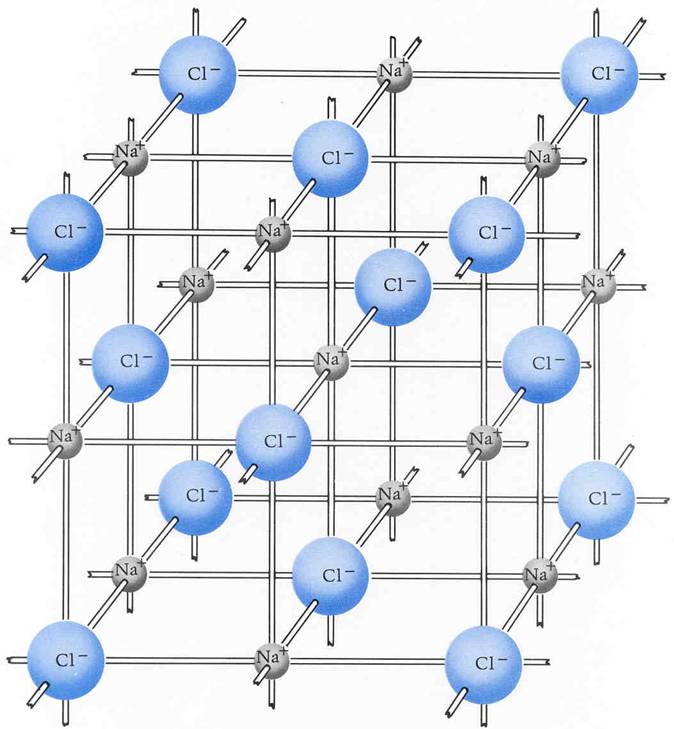
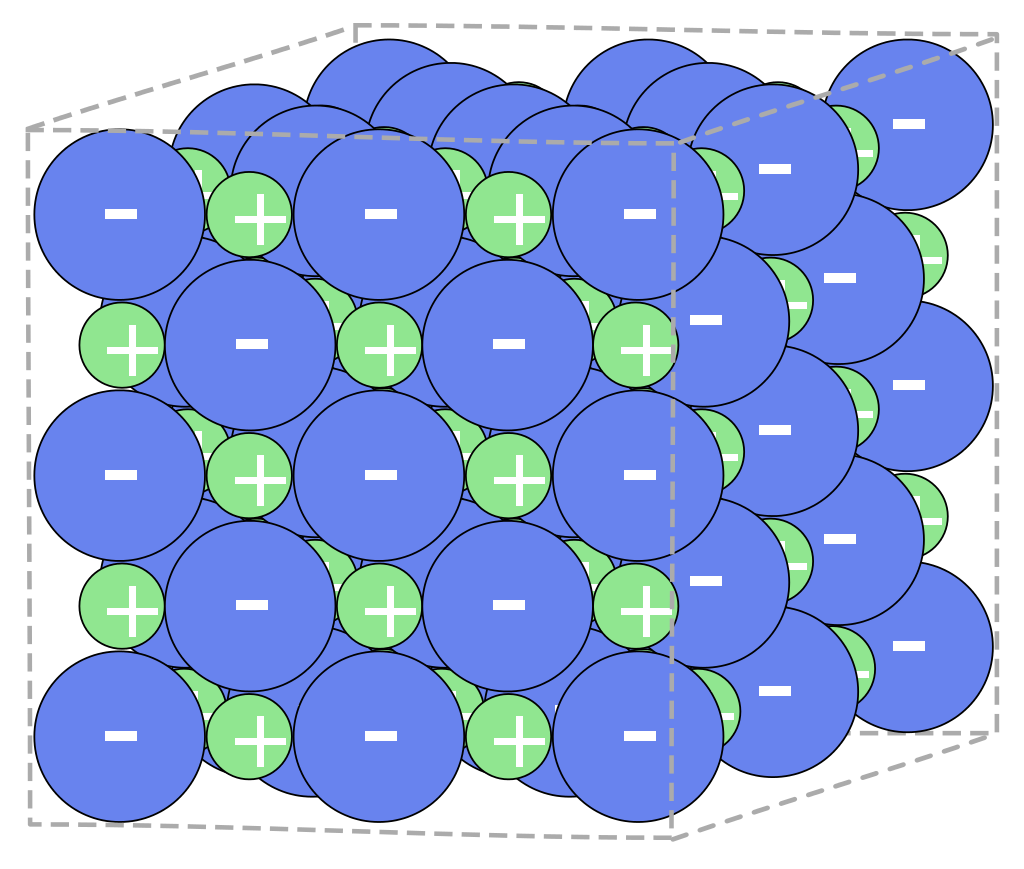
Ionengitter. Kristallographie. Chemische Bindung. jedes Atom hat sechs direkte Nachbarn. Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand.

Ionengitter / Salze Und Ionengitter Erklart Inkl Ubungen Ionen bilden einen festen ionenverband
Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen.
Ionengitter • einfach erklärt, Eigenschaften und Beispiele · [mit Video]
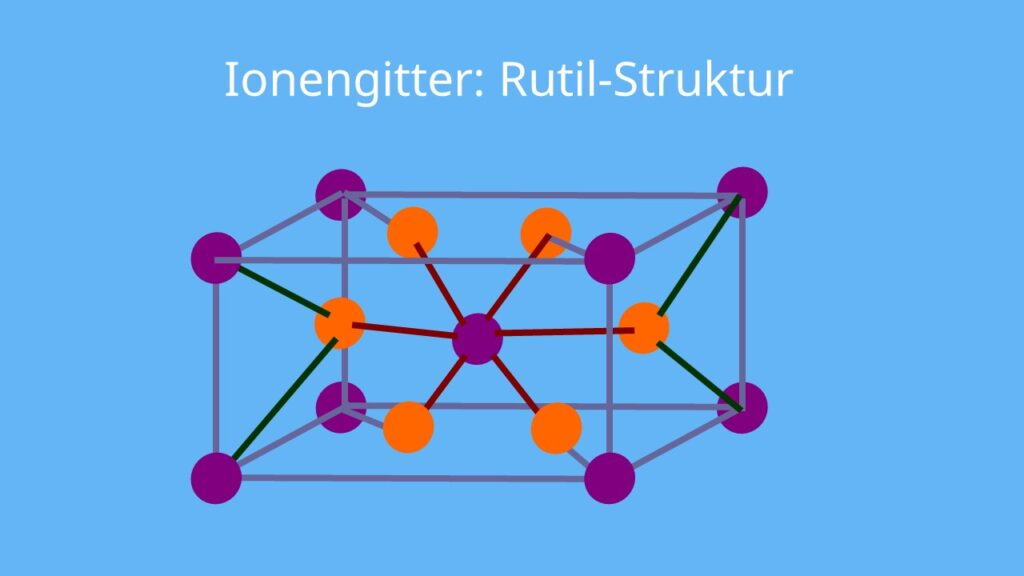
Die Definition eines Ionengitters Ein Ionengitter liegt nun vor, wenn sich die Ionen innerhalb des Stoffes gitterförmig anordnen. Ionen - eine einfache Erklärung aus der Physik lonen sind essentielle Bestandteile der Physik und der Chemie. Es handelt sich um geladene.
Bildung des Ionengitters Chemiewiki
Die Lehre der Kristalle nennt man Kristallographie. Erklärung anhand des Kochsalzgitters (ein Ionengitter) Ionengitter: Regelmäßige Anordnung von Ionen in einem Kristall Kochsalz ( Natriumchlorid) besteht aus Natriumionen (Na+ positiv geladen) und Chloridionen (Cl-, negativ geladen).

Die Ionenbindung YouTube
Ein Ionengitter ist die regelmäßige, dreidimensionale Anordnung von positiv und negativ geladenen Ionen in einem Salz. Durch elektrostatische Anziehungskräfte halten sich die Ionen im Gitter zusammen, was Salzen ihre typische feste Struktur und hohe Schmelzpunkte verleiht. Videos anschauen Übungen starten Arbeitsblätter anzeigen Lehrer* innen
Ionengitter / Salze Und Ionengitter Erklart Inkl Ubungen Ionen bilden einen festen ionenverband
Chemische Bindung. Unter einem Ionenkristall oder Ionengitter versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen eines homogenen Stoffes im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch die Ionenbindung.
Referat Die Ionenbindung
Ein Ionengitter ist eine gleichmäßige Aufstellung, die aus positiv (Kationen) und negativ (Anionen) geladenen Ionen besteht. Durch ihre entgegengesetzten Ladungen ziehen sie sich gegenseitig an und bilden eine Struktur, die wie ein Gitter aussieht: das Ionengitter.
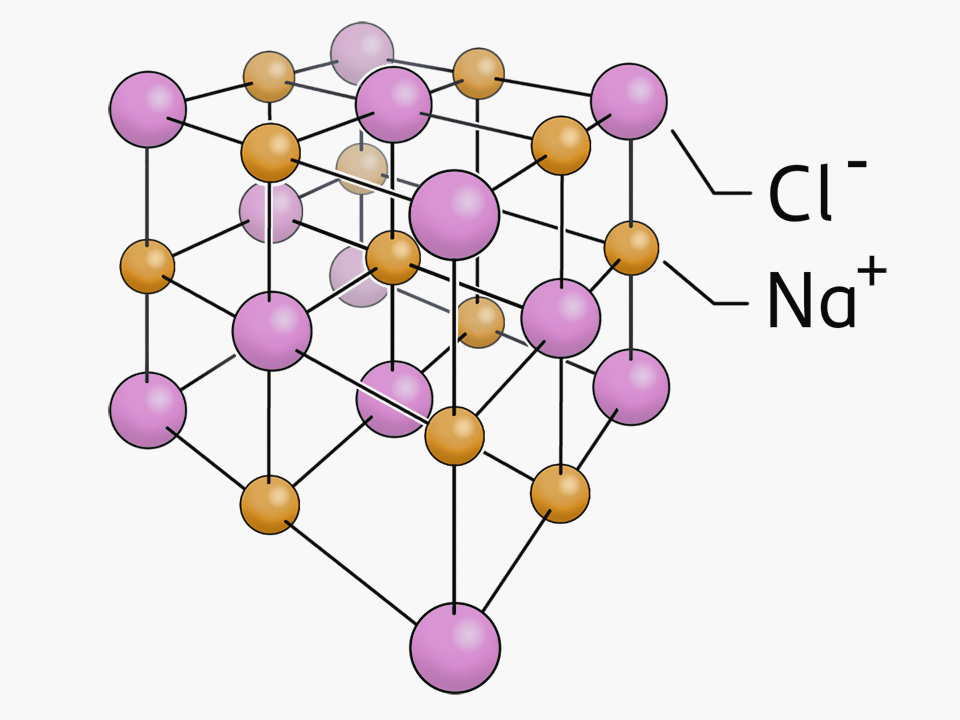
Ionengitter / KATIONEN UND ANIONEN Chemie Verbindungen
Aufbau des Ionengitters. Ein Ionengitter wird aus Kationen und Anionen aufgebaut, dabei stehen die Anionen und Kationen so im Verhältnis zueinander, dass das Prinzip der elektrischen Neutralität (Salze sind i.d.R ungeladen) erfüllt wird. Dabei spielt das Verhältnis der Radien von Kationen und Anionen eine entscheidende Rolle.
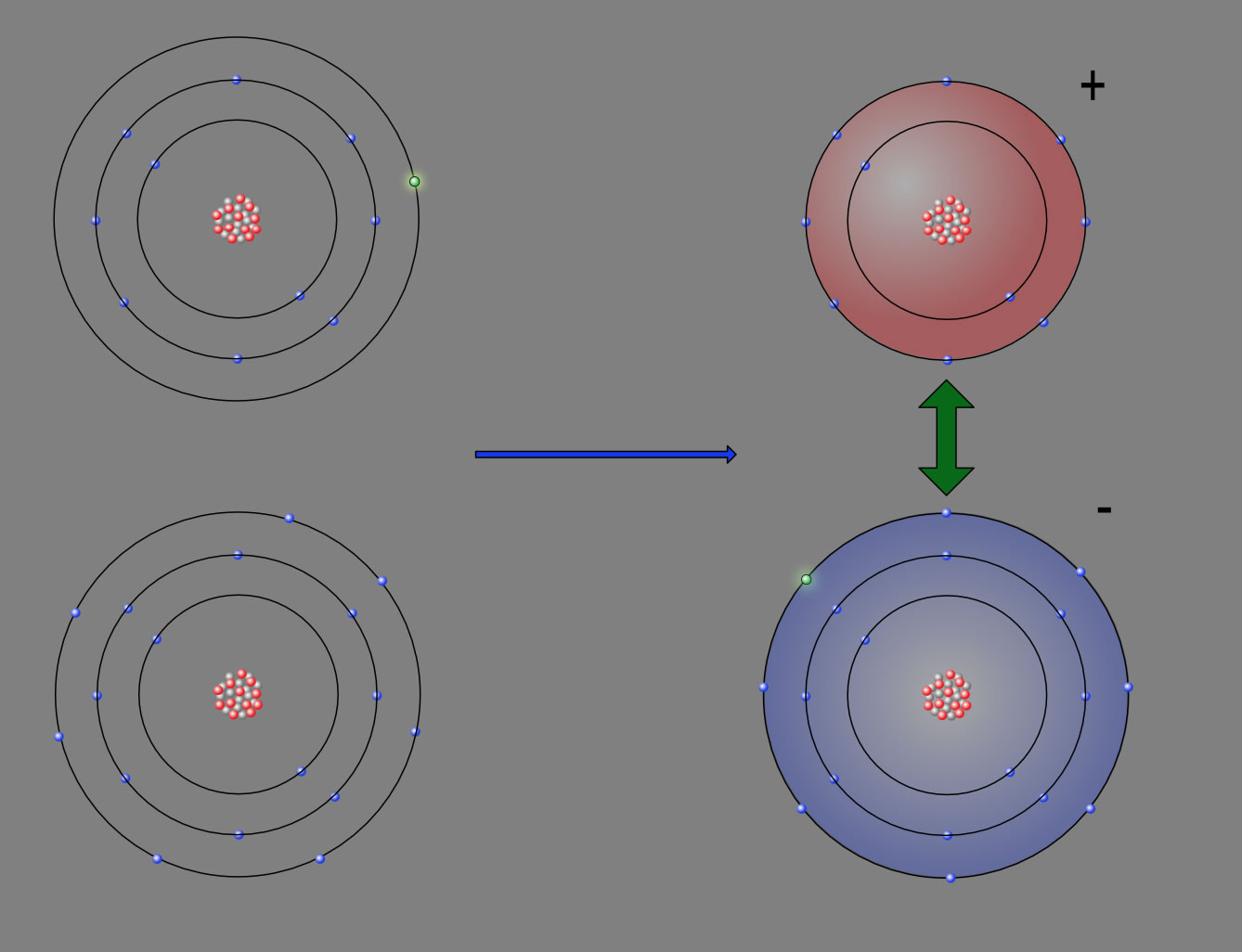
Die Ionenbindung
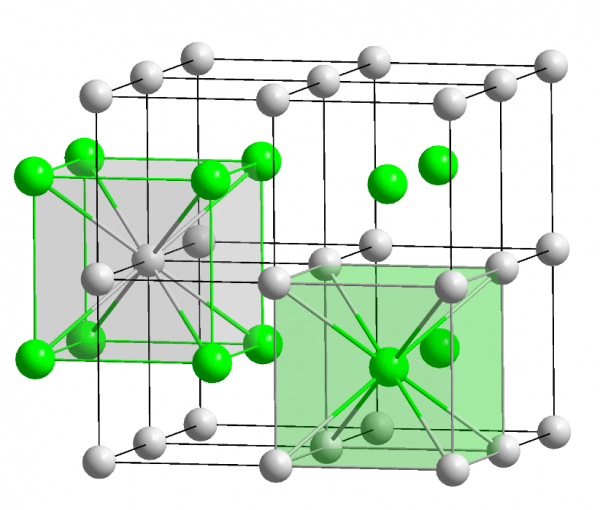
Bildung des Ionengitters. Wenn sich Ionen verbinden,entsteht ein Ionengitter, da sich die gleichgeladenen Ionen abstossen und die gegengleichgeladenen Ionen anziehen. Somit ist die Bildung des Ionengitters eigentlich eine Optimierung, denn die gleichgeladenen Ionen versuchen möglichst weit voneinander entfernt zu sein, während die.
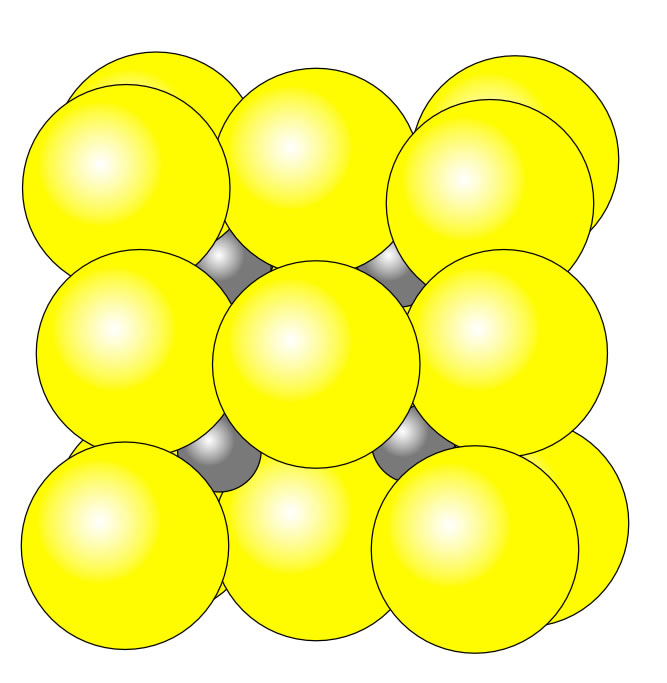
Ionengitter Chemie Fur Mediziner Chemische Bindung Chemgapedia / ionengitter ionenkristall
Was ist Gitterenergie? Die Gitterenergie (Gitterdissoziationsenergie) ist die Energie, um ein Ionengitter zu zerlegen und Ionen in gasförmigen Zustand zu bringen. Die Einheit ist kJ/mol. Was ist der Unterschied zwischen Gitterenergie und Gitterenthalpie?

Kann mir jemand die Ionenbildung erklären (evtl mit Beispiel)? (Schule, Chemie, Ionen)
Ionengitter, Kristallgitter aus positiven und negativen Ionen. Ionengitter liegen bei den meisten Salzkristallen vor. Eines der bekanntesten Beispiele ist…

IonenbindungIonenKationen und Anionen YouTube
Ionengitter - was ist das? Bei Bindungen streben Atome danach, ein sog. Elektronenoktett, auch Edelgaskonfiguration genannt, anzustreben. Viele chemische Verbindungen sind dabei durch Elektronenübergänge gekennzeichnet, sprich ein oder mehrere Elektronen werden von einem Reaktionspartner an den anderen abgegeben.
Ionenbindung lernen mit Serlo!
Unter einem Ionenkristall oder Ionengitter versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen eines homogenen Stoffes im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch die Ionenbindung.

1.3.2 Ionenbindung _main.utf8
Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen.